神经干细胞(NSC)和内皮细胞(EC)之间的相互作用对于体内中枢神经系统(CNS)的神经血管网络的建立和神经再生至关重要。但是,用于研究NSC和EC在三维(3D)环境中相互作用的平台仍然很少。
最近,国立台湾大学的徐善慧团队,在Materials Science & Engineering C发表了题为“Angiogenic potential of co-spheroids of neural stem cells and endothelial cells in injectable gelatin-based hydrogel”的文章,研究团队首先基于壳聚糖(CS)基底共同培养NSCs和ECs,快速自组装成NSC/EC共球体。通过基因和蛋白表达分析,NSC/EC共球体中的NSCs比利用常规培养皿基底二维(2D)培养的NSCs表现出更大的分化潜力。随后将共球体封装在CS或者明胶(Gelatin)水凝胶中,为共球体提供一个3D细胞外基质(ECM)类环境,以长期深入探究细胞-细胞相互作用。结果显示,在成纤维细胞生长因子(FGF2)的诱导下,共球体在Gelatin水凝胶环境中展现出更好的细胞活力,在其表面形成了管状类结构,这表明与NSCs共培养的ECs,在含有FGF2的Gelatin水凝胶环境下可增强其血管生成潜能。最后,采用捷诺飞研发的Bio-Architect® WS 生物3D打印机,进一步展现出由NSC/EC共球体和Gelatin水凝胶组成的生物墨水具有可注射性和可打印性,这为将来利用生物3D打印技术直接打印NSC/EC共球体构建仿生的神经血管结构提供了可能。
神经干细胞(NSCs)移植已成为治疗神经退行性疾病最有希望的策略之一。因此,研究支持NSCs生长的自然环境将有助于今后的疾病治疗。一方面,NSCs和ECs之间的相互作用对于CNS的神经血管网络的建立和神经再生至关重要。ECs分泌生长因子支持NSCs的增殖、存活和分化,分泌黏附分子维持神经血管网络结构,且ECs与NSCs的直接相互作用影响着NSCs自我更新能力和最终分化结果。同时,通过与NSCs共同培养可触发ECs的血管生成,形成的血管网络负责CNS中的营养、氧气和代谢废物的运输。另一方面,细胞外基质(ECM)环境对于NSCs和ECs的长期生长和细胞-细胞相互作用具有重要影响。与传统培养板/瓶(TCPS)相比,在生物材料基质中培养的细胞表现出更好的细胞活力或明显的细胞特性。CS和Gelatin水凝胶作为类ECM环境可支持NSC和EC细胞长期生长并诱导血管生成。因此,研究团队采用生物材料来共培养NSCs和ECs,以增强细胞-细胞相互作用和细胞-基质相互作用,并结合生物3D打印技术最终生成充满神经血管细胞的3D构建体。
台湾大学徐善慧团队首先分别在壳聚糖(CS)基底和透明质酸修饰的壳聚糖(CS-HA)基底上共培养NSCs和ECs,以此探究NSCs和ECs能否自组装成NSC/EC共球体。观察发现,对比于在CS基底上共培养的NSCs和ECs,在CS-HA基底上共培养的NSCs和ECs能迅速组装成更大、更紧密和更完整的NSC/EC共球体(图1A和B)。随后,该团队分析了与NSCs干性和分化潜能相关的特异性蛋白的基因转录表达水平,以反映NSCs和ECs的细胞-细胞相互作用。观察发现,对比于在TCPS基底上与ECs共培养的NSCs,在CS-HA基底上与ECs共培养的NSCs表现出干性降低和分化增强的特征(图1C),这表明NSCs与ECs在CS-HA基底下共培养时建立了更好的细胞-细胞相互作用。
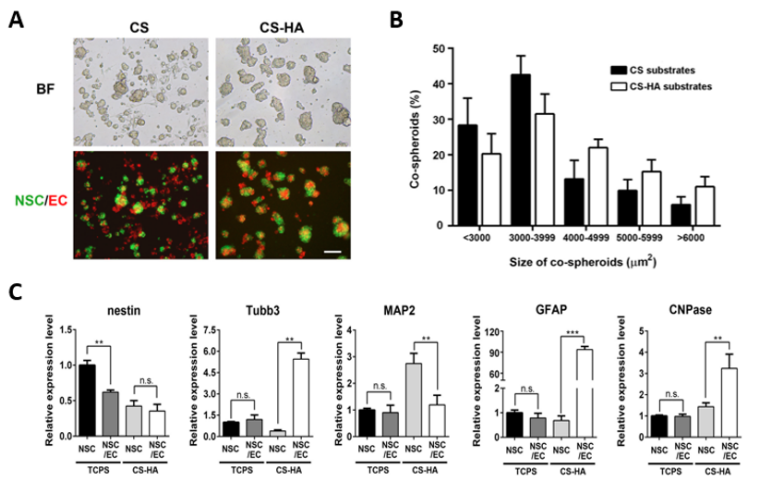
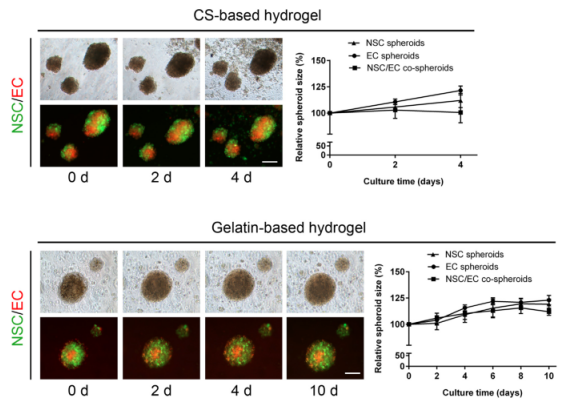
图2 细胞共球体分别在壳聚糖水凝胶和明胶水凝胶中的生长形态和相对生长速率
进一步,研究团队在水凝胶中添加成纤维细胞生长因子(FGF2)以期望促进共球体的生长和诱导ECs的血管新生。观察发现,共球体的生长速度在添加FGF2前后并没有明显的差别。然而在培养至第6天时,共球体表面出现类似血管新生现象并随后形成了类似血管网结构,这一发现仅存在gelatin水凝胶体系中(图3)。这些数据表明,由于适当的NSC-EC和细胞-基质相互作用,将NSC/EC球蛋白封装在含有FGF2的gelatin水凝胶基质中可能会诱导毛细血管网络的形成。
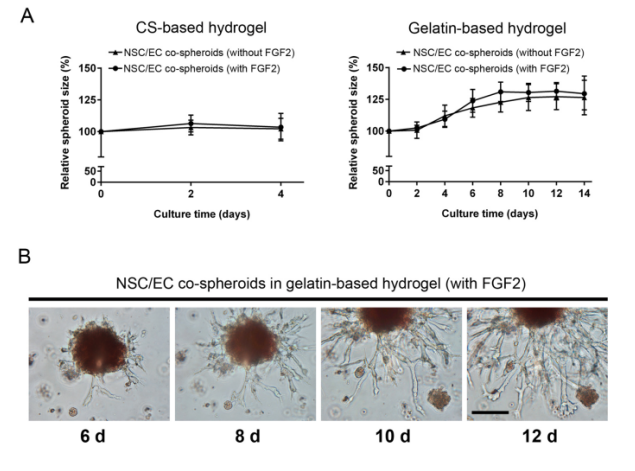
图3 在FGF2因子刺激下,NSC/EC细胞共球体的生长速率和毛细管状结构的形成
进一步地,研究团队将NSC/EC共球体和Gelatin配成生物墨水,并借助捷诺飞研发的Bio-Architect® WS 生物3D打印机构建了载有NSC/EC共球体的3D Gelatin水凝胶结构,在随后的培养中形成多细胞毛细血管样结构。这一结果初步验证了该生物墨水具有可注射性和可打印性,为将来利用生物3D打印技术直接打印NSC/EC共球体构建仿生的神经血管结构提供了可能。
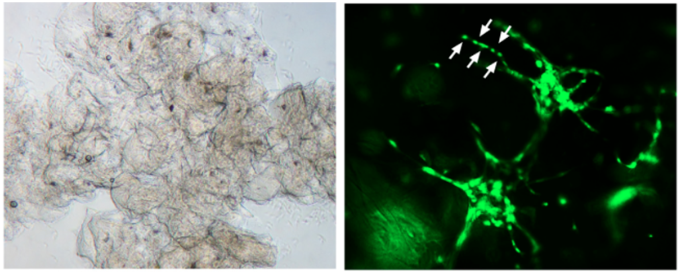
图4. NSC/EC共球体和Gelatin作为生物墨水的可打印性探究
结论:研究团队采用了生物材料以增强细胞-细胞相互作用和细胞-基质相互作用,来最终生成充满神经血管细胞的构建体。NSC和EC在CS-HA上共培养可自组装为细胞共球体,NSCs具有朝着胶质细胞分化的趋势。NSC/EC共球体封装在明胶体系基质中,ECs显示出血管生成活性。NSC/EC共球体和明胶体系基质混合可制作生物墨水,具有可注射性和可打印性,结合生物3D打印技术,为构建载有NSC/EC共球体的神经血管单元提供了可能,可用于基础研究和个性化医学。
本文采用捷诺飞研发生产的生物3D打印工作站Bio-Architect®WS。
Bio-Architect® WS兼容、微滴、光固化等多种打印喷头和成型平台,为每个打印步骤提供最佳条件,拓宽打印材料范围。可打印材料包括:细胞系和细胞株、天然生物材料、高分子材料、生物无机材料等。

论文信息:
Hao-Wei Han, Yung-Te Hou, Shan-hui Hsu. Angiogenic potential of co-spheroids of neural stem cells and endothelial cells in injectable gelatin-based hydrogel. [J]. Materials Science & Engineering C, 99 (2019) 140–149.
论文连接:
https://doi.org/10.1016/j.msec.2019.01.089.