【导读】
人体内葡萄糖稳态由多种组织协同调控,包括肝脏、胰岛、脂肪和肌肉等。其中肝脏和胰岛在维持正常血糖方面具有双重功能。在禁食状态下,胰岛α-细胞分泌胰高血糖素,促使肝脏中糖原分解产生肝糖,增加血液中葡萄糖水平;进食后,胰岛β-细胞分泌胰岛素促进葡萄糖进入肝脏合成肝糖原,从而调节血糖的稳态。二者协调作用的失衡往往导致血糖水平失调和代谢紊乱,如导致2型糖尿病(T2DM)的发生。现阶段针对T2DM的研究主要依赖于细胞或动物模型,缺乏多器官间的互作微环境,且存在显著的物种差异。
为了在体外能够重现不同组织间的动态相互作用,精确模拟人体代谢反应,来自中国科学院大连化学物理研究所的秦建华研究员团队将类器官技术与微流控芯片技术相结合,提出了一种基于人诱导多能干细胞(hiPSCs)的多种类器官互作系统,可在生理或病理条件下再现人体相关的肝-胰岛轴,模拟肝脏—胰岛器官的串扰作用,并以此研究正常和T2DM条件下的糖代谢反应。相关论文“Microengineered Multi-Organoid System from hiPSCs to Recapitulate Human Liver-Islet Axis in Normal and Type 2 Diabetes”发表在Advanced Science 期刊上。
如图1所示,研究人员设计了一款具有分区微孔阵列结构的微流控芯片,构建出hiPSCs来源的肝、胰岛类器官,并实现了二者的动态培养和互作系统。在灌注培养条件下,类器官的活性增强,可稳定培养长达一个月。
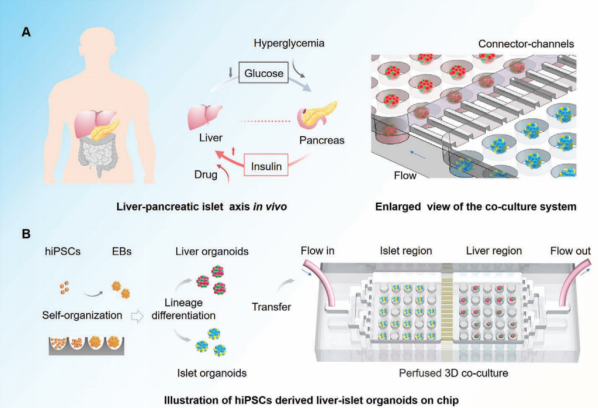
图1. 分区微孔阵列芯片模拟人肝-胰岛轴互作系统示意图
肝脏和胰岛类器官形成之后,研究人员采用免疫蛋白染色和RT-PCR对类器官的功能进行了验证(图2)。结果显示,在肝脏类器官中,P450标记物(CYP3A4)、成熟肝细胞(ALB)和胆管细胞(CK7)标记物高度表达,显示出肝脏类器官的细胞异质性;在胰岛类器官中,特异性标记物β-细胞(胰岛素,INS),α-细胞(胰高血糖素,GCG),γ-细胞(胰腺多肽,PPY),δ-细胞(生长抑素,SST)的表达验证了该研究中产生的异质性胰岛类器官包含四种内皮类型,类似于人胰岛结构。
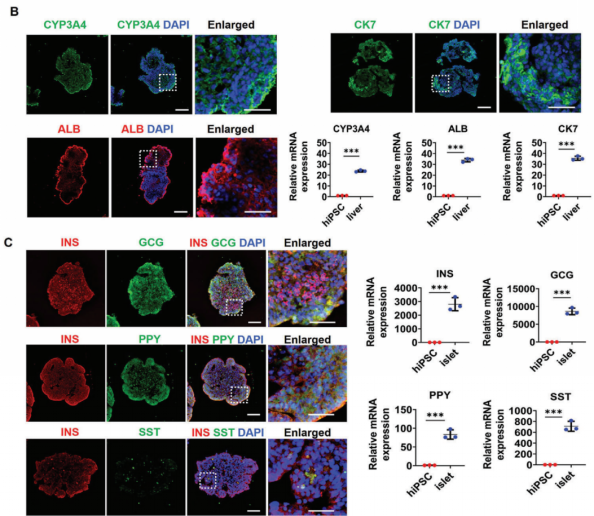
图2. 鉴定肝脏和胰岛类器官中的相关特异性蛋白和基因表达
为了探究芯片上肝脏和胰岛类器官的功能保持,研究人员评估了单一和共培养模式下类器官的细胞活力与功能基因的表达情况(图3)。与单一培养相比,共培养环境下的胰岛类器官和肝脏类器官存活率较高,且相关特异性功能基因的表达明显增强。
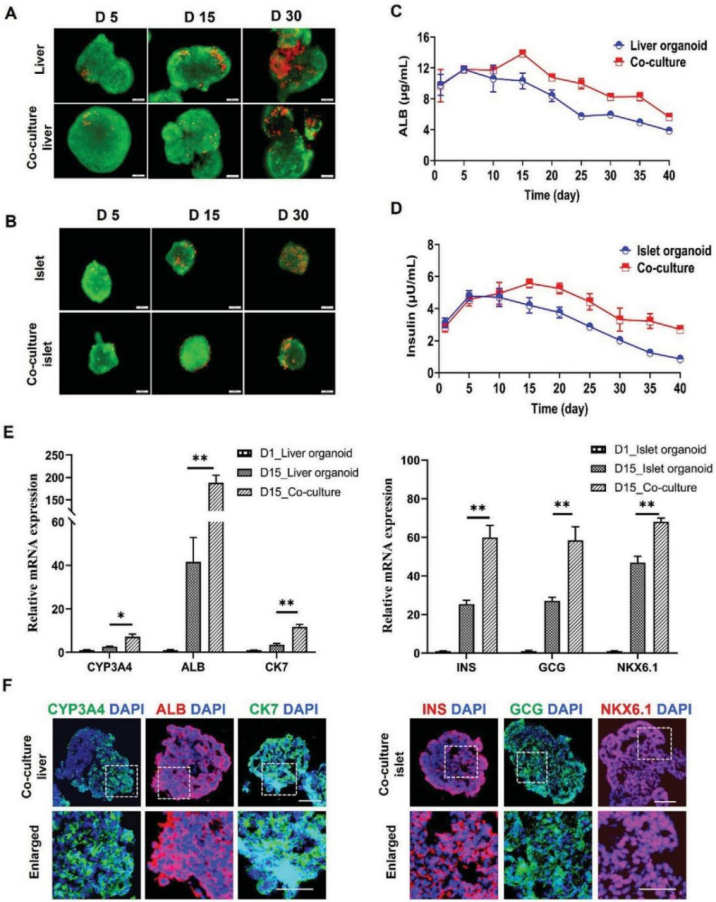
图3. 单培养和共培养条件下肝脏和胰岛类器官细胞活力和功能比较
进一步,研究人员进行了替代GTT(标准口服葡萄糖耐量试验)分析,以此评估多器官芯片系统中胰岛和肝脏类器官之间可能的相互作用。结果显示,共培养系统促进了由葡萄糖刺激的胰岛素分泌,并增加了肝脏类器官中的葡萄糖利用,证实了多类器官芯片系统可以有效模拟胰岛β-细胞分泌胰岛素对葡萄糖的调节,并刺激肝脏摄取葡萄糖(图4)。
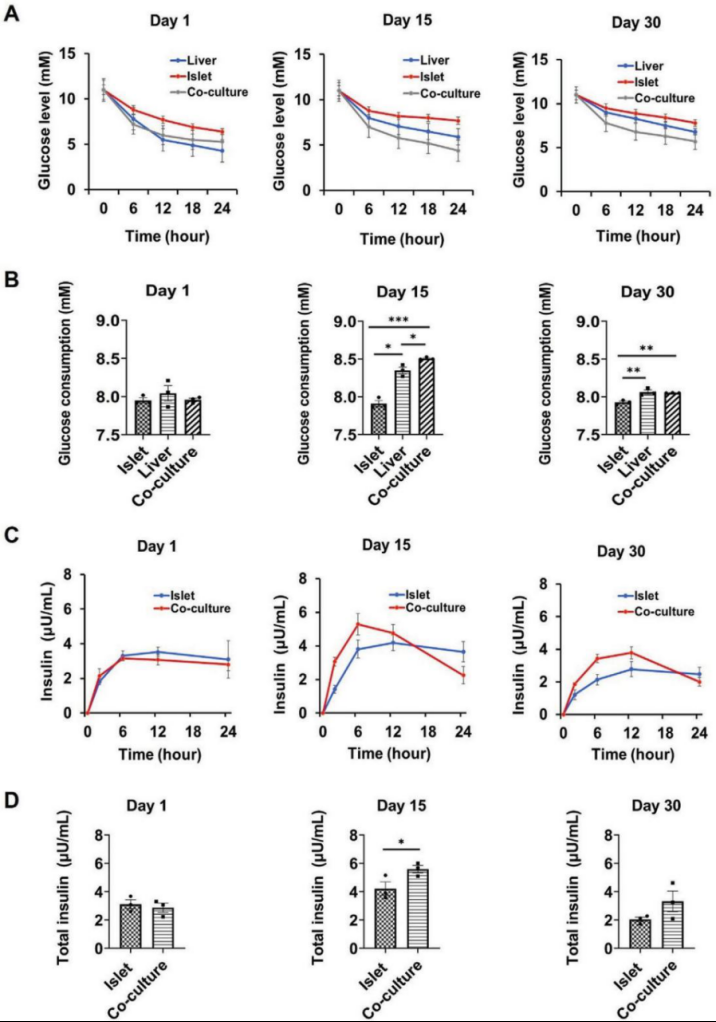
图4. 灌流环境下多器官芯片系统中肝脏和胰岛类器官间相互作用表征
慢性高血糖是T2DM的主要病因,涉及多个代谢功能器官,包括肝脏和胰岛细胞。在高血糖环境下,肝脏和胰岛类器官中葡萄糖转运蛋白(GLUT1和GLUT4)的表达水平降低,模拟了糖尿病早期发生的病理过程,在使用二甲双胍治疗后,胰岛和肝脏类器官中葡萄糖转运蛋白和基因(SLC2A1和SLC2A4)的表达显著增加,反映了二甲双胍治疗后葡萄糖转运功能的恢复(图5)。
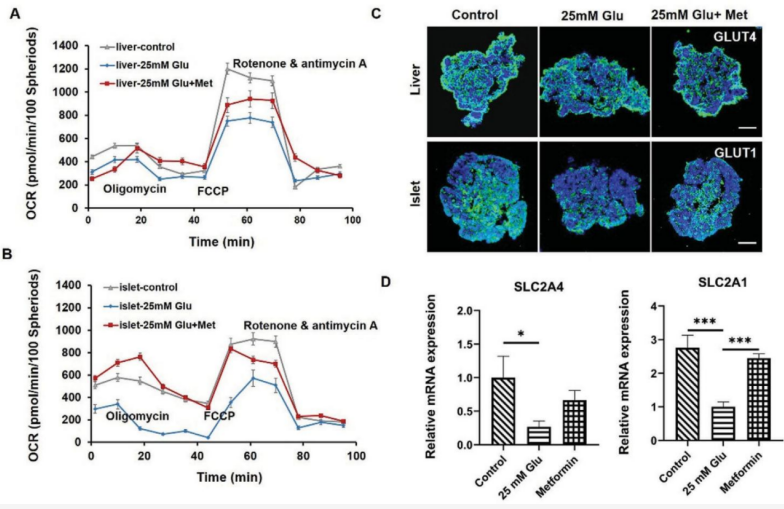
图5. 评估高血糖状态和二甲双胍治疗后胰岛-肝类器官系统的线粒体功能和葡萄糖转运能力
综上所述,该研究团队开发出一款具有分区功能的微孔阵列芯片,实现了肝、胰岛类器官的长期稳定培养和功能维持,并以此研究了生理和病理条件下机体的糖代谢反应。该系统的优势在于它能够模拟与人类相关的肝脏和胰岛器官对外部高血糖刺激和药物反应的功能耦合,以重建多器官协作系统,将有望成为T2DM研究和药物开发强有力的技术平台。