引言
光学相干断层血管造影(OCTA)是一种非侵入成像技术,可用于获取视网膜的高分辨率图像,对于眼科、神经系统和心脏疾病的诊断具有重要意义。然而,现有的基于阈值的分割方法受图像伪影影响大,且对小血管的检测效果不佳。近期研究探索了使用卷积神经网络(CNN)自动分类和分级OCTA图像的可行性,但这些系统的可解释性有限,并可能受到训练样本偏差的影响。因此,研究者在血管分割图基础上,计算血管分割图中与疾病相关的生物标志物来判断疾病,如血管密度、半径或曲折度等。目前,基于阈值分割的OCTA血管分割方法需手动调整,且对小血管监测效果不佳。机器学习方法因标注数据不足而表现不理想,迁移学习被提出作为解决方案。最近,Linus Kreitner等人在IEEE医学影像学上发表了名为Synthetic optical coherence tomography angiographs for detailed retinal vessel segmentation without human annotations的研究成果,通过使用Rauch和Harders的空间殖民模型生成OCTA血管图,改善了图像生成速度和复杂性,且生成的血管结构更逼真,从而为视网膜内的血管分割提供了一种新的研究方向。
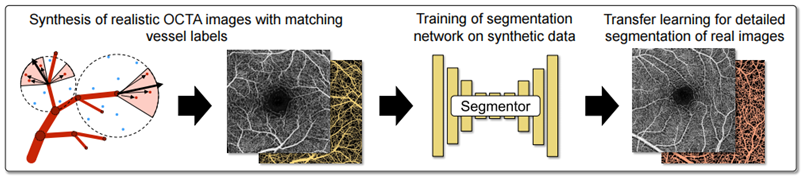
图1 论文迁移学习的模型图
研究方法
1. 对视网膜血管的统计模拟
研究者在一个3×3×1.76 mm³的模拟空间中用来生成血管模拟图,然后将图像投影到二维空间中,因为实际中OCTA图像大多都是2D图像。采用如下的策略对血管生成进行模拟:
(1)在视网膜血管模拟中,动脉树提供氧气,静脉树移除二氧化碳。每次迭代随机放置氧汇吸引动脉节点,血管直径越大,吸引力越强。动脉连接氧汇后,氧汇变为二氧化碳源,吸引静脉节点。完成后,二氧化碳源被移除,模拟气体交换和排出。
(2)如图2所示每个叶节点有一个感知锥体。如果吸引点在锥体内,它引导血管生长。叶节点有最佳分支向量,新子节点沿此向量生成,位置由伸长向量确定。若吸引角度超阈值,节点分叉生成两个子节点,分叉角度依Murray定律计算,父血管半径更新,递归调整至根节点。
(3)如图2所示,中间节点会在特定范围内(截锥体,半径为δ)选择吸引点,并确保吸引点与节点之间的角度满足ϕ1、ϕ2和γ的要求。防止不现实的分枝角度,选择与平均吸引向量最接近的最佳分枝向量(S⃗vopt)用于增殖,新的子节点位置通过公式计算确定,从而保证新生血管的方向和位置符合生物学规律和实际血管网络的自然发展。
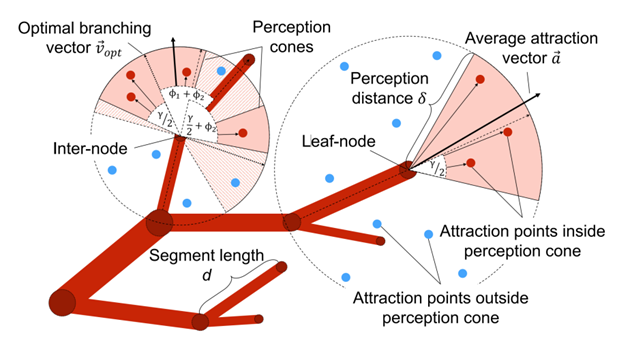
图2 叶节点和中间节点示意图
(4)模拟空间动态扩展以适应血管生长,血管尺寸按Murray法则控制,SVC和DVC独立参数化以研究其行为。
(5)为了成功模拟黄斑无血管区(FAZ),实验采取了以下策略:避免在FAZ区域内放置氧汇,减少FAZ附近的血管分枝,增加中心旋转项使FAZ更圆,并通过加权项调整生长方向以避免完全圆形。FAZ的半径通过正态分布随机选择,模拟自然变异(图3)。
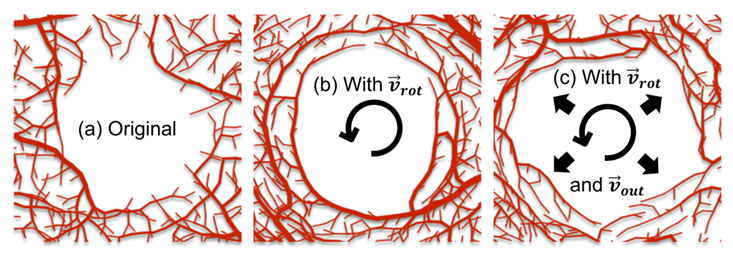
图3 FAZ在加入旋转向量和向外向量的示意图
2. 从血管图中生成图像和标签
生成血管图后,研究者对模拟空间进行体素化,并沿z轴最大强度投影,计算抗锯齿灰度图像。通过二值化图像生成合成血管注释。为准确区分小血管,研究者将所有OCTA图像通过双线性插值上采样至像素大小为约2.5 µm。在上采样的模拟空间中直接生成合成分割标签,以确保血管直径的准确表示。
3. 调整和改进生成的合成图像
使用合成血管图训练分割网络在真实数据上效果较差,尽管血管几何形态模拟得较真实,但图像对比度和信噪比不同。实际OCTA图像常有噪声、低对比度区域和模糊边缘。尽管尝试了剪切、拉伸和二项噪声增强,效果不显著。为提高在真实图像上的分割性能,提出了三种高级策略来适应训练图像的对比度。
(1)研究者设计了一个多步骤的人工噪声模型(图4),用于模拟真实数据中的伪影。首先,生成密集背景噪声图像,并通过Beta分布噪声层调整信噪比。然后,计算每个像素的噪声调制因子,生成Beta噪声矩阵模拟散斑噪声和局部亮度调整。最后,生成局部对比度变化的控制点矩阵,并通过插值得到对比度调整矩阵。最终输出的噪声模型包括随机降采样和上采样,模拟模糊边缘和较低质量图像。
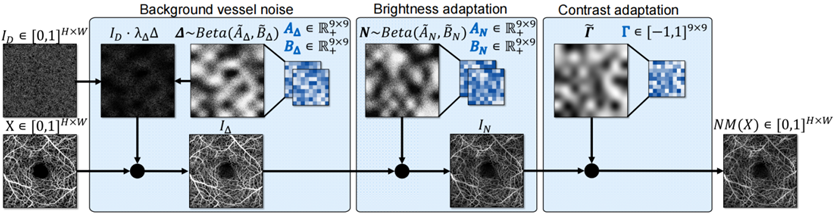
图4 多步骤人工噪声模型
(2)通过对抗训练进行噪声建模(图5),通过最大化给定训练标签的分割损失来计算每张图像的强度变换,从而有效提升分割网络在处理真实数据时的性能。
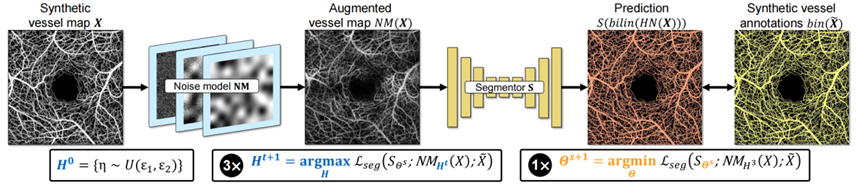
图5 通过对抗训练进行噪声建模示意图
(3)第三种策略利用神经网络学习变换(图6),将合成图像转换为更接近真实图像的风格,提升了分割网络在处理真实数据时的性能。采用了CycleGAN框架,通过生成器和判别器网络进行图像转换,并保持图像内容的一致性。无需真实图像的血管标注,通过分割网络直接计算循环一致性损失。引入本体映射损失约束生成器,确保分割网络适用于真实数据。
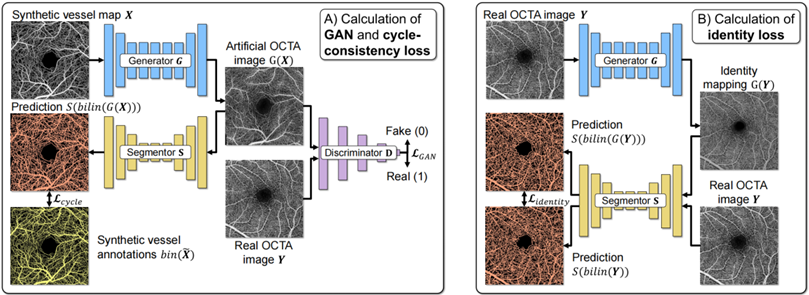
图6 GAN原理示意图
评估
图7定量地分析了各个模型的训练结果性能参数。可以发现,在人工标注的数据集上,监督模型在数量上表现最佳,与先前研究的结果一致,这验证了本文选择nnU-Net架构的正确性。该方法与额外的对比度自适应是可靠的,在提取真实的分割地图跨所有数据集,本文的方法优于传统的计算机视觉算法(图7)。
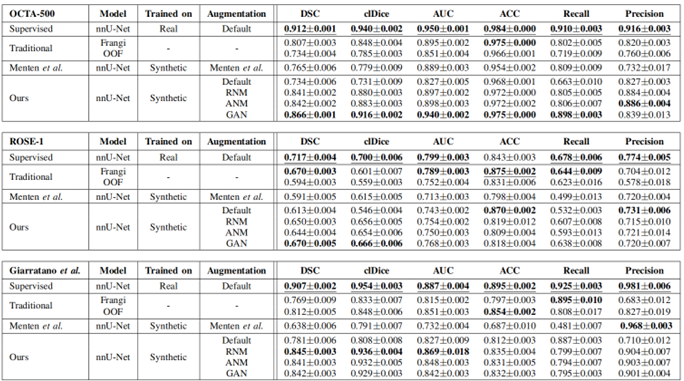
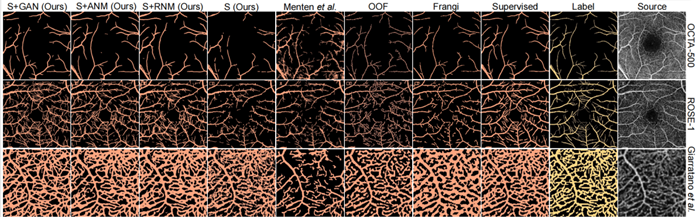
图7 各个模型性能定量分析与定性分析结果
如图8所示,通过控制合成血管标注中的最小血管半径,该网络可以被设置为创建具有不同细节级别的分割。这使对具有不同标签预测的数据集进行基准测试。如图9所示,本文的方法能够在分辨率低的区域恢复血管,这些区域很难手动标注。网络将运动和伪影解释为血管,因为本文没有明确地针对它们进行网络调整。如图10所示,本文的方法在低对比度区域提取细节血管分割图的领域内更加有优势。
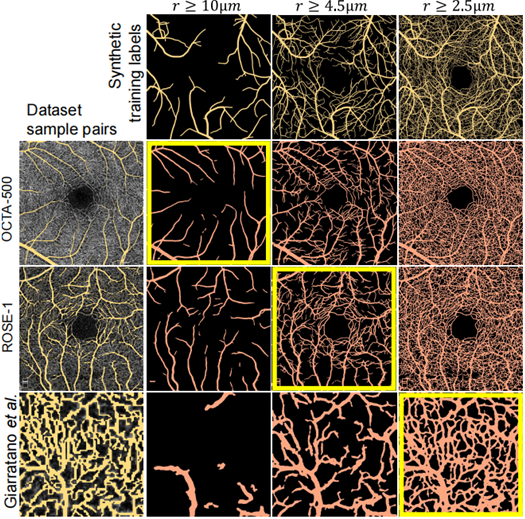
图8 不同最小血管半径的分割结果

图9 不同分辨率的血管分割结果
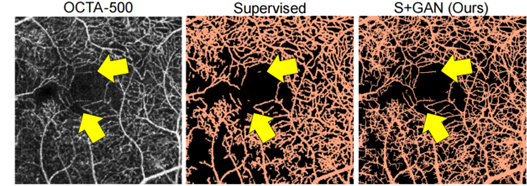
图10 在低对比度区域提取细节血管分割方法对比
总结